输华流程
一、备案
首次进口的属于补充维生素、矿物质等营养物质的保健食品其营养物质应当是列入保健食品原料目录的物质。《食品安全法》
上市保健食品境外生产商
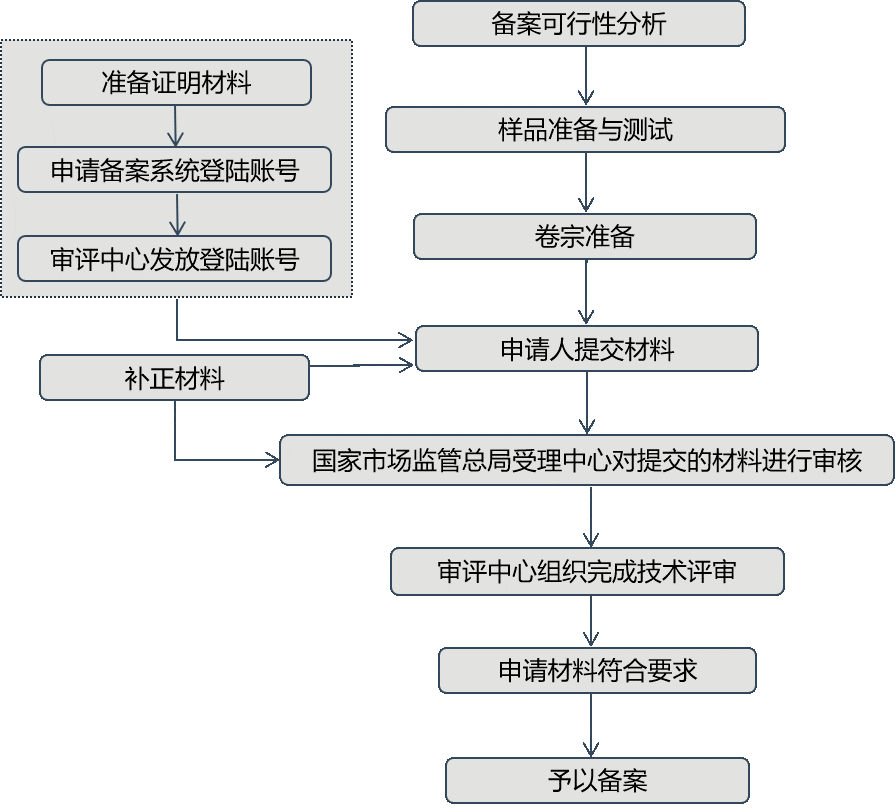
- 保健食品备案登记表,以及备案人对提交材料真实性负责的法律责任承诺书;
- 备案人主体登记证明文件;
- 产品配方材料;
- 产品生产工艺材料;
- 安全性和保健功能评价材料;
- 直接接触产品的包装材料的种类、名称及标准;
- 产品标签、说明书样稿;
- 产品技术要求材料;
- 产品名称相关检索材料;
- 具有合法资质的检验机构出具的符合产品技术要求全项目检验报告;
- 其他表明产品安全性和保健功能的材料。
- 产品生产国(地区)、政府主管部门或者法律服务机构出具的注册申请人为上市保健食品境外生产厂商的资质证明文件;
- 产品生产国(地区)政府主管部门或者法律服务机构出具的保健食品类似产品上市销售一年以上的证明文件;
- 产品生产国(地区)或者国际组织与备案保健食品相关的技术法规或者标准原文;
- 产品在产品生产国(地区)上市的包装、标签说明书实样
- 由境外备案/注册人常驻中国代表机构办理备案事务的,应当提交《外国企业常驻中国代表机构登记证》扫描件;境外备案人委托境内的代理机构办理备案事项的,应当提交经过公证的委托书原件以及受委托的代理机构营业执照扫描件。
- 备案材料应使用中文,外文材料附后。外文证明性文件、外文标签说明书等中文译本应当由中国境内公证机构进行公证,与原文内容一致。
- 境外机构出具的证明文件、委托书(协议)等应为原件,应使用产品生产国(地区)的官方文字,备案人盖章或法人代表(或其授权人)签字,需经所在国(地区)的公证机构公证和中国驻所在国使领馆确认。
- 境外备案委托境内的代理机构办理备案事项的,委托书应载明备案被委托单位名称、产品名称、委托事项及委托书出具日期。
- 产品功效成分或标志性成分;
- 卫生学;
- 稳定性试验;
- 产品技术要求全项目检验;
- 其他若有必要的试验。
| 主要步骤 |
预估时间 |
| 备案可行性分析 |
3个工作日 |
| 样品准备 |
视具体情况而定 |
| 试验检测 |
4个月 |
| 卷宗编写与提交 |
1个月 |
| 受理机构受理 |
1个工作日 |
| 补正资料 |
视具体情况而定(一般1个月内) |
| 作出审批决定,并发出证书 |
视具体情况而定(一般1周内) |
| 合计 |
6-7个月 |
二、注册
首次进口的属于补充维生素、矿物质等营养物质的保健食品其营养物质应当是列入保健食品原料目录的物质。《食品安全法》
上市保健食品境外生产商
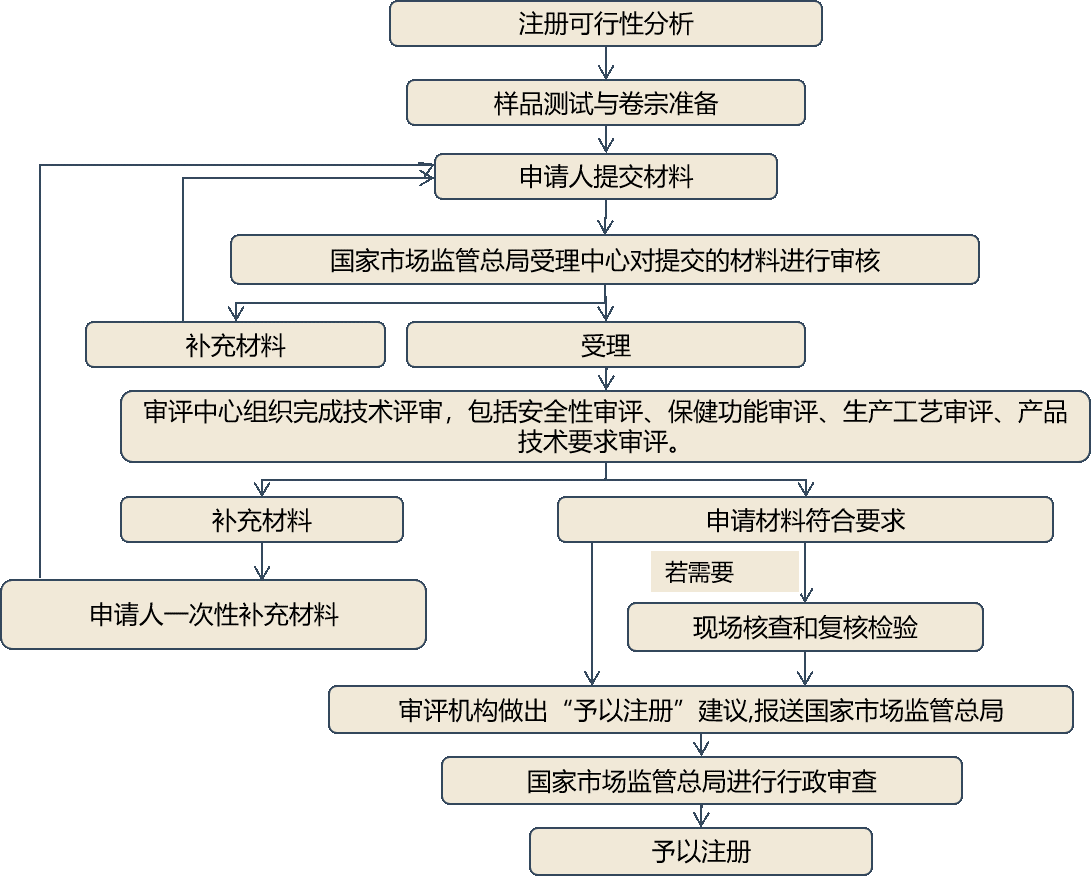
- 保健食品注册申请表,以及申请人对申请材料真实性负责的法律责任承诺书;
- 注册申请人主体登记证明文件;
- 产品配方材料;
- 产品生产工艺材料;
- 安全性和保健功能评价材料;
- 直接接触保健食品的包装材料种类、名称、相关标准等;
- 产品标签、说明书样稿;
- 产品名称中的通用名与注册的药品名称不重名的检索材料、产品名称与批准注册的保健食品名称不重名的检索材料;
- 产品研发报告 ;
- 3个最小销售包装样品;
- 其他与产品注册审评相关的材料。
- 其他表明产品安全性和保健功能的材料。
- 产品生产国(地区)、政府主管部门或者法律服务机构出具的注册申请人为上市保健食品境外生产厂商的资质证明文件;
- 产品生产国(地区)政府主管部门或者法律服务机构出具的保健食品类似产品上市销售一年以上的证明文件;
- 产品生产国(地区)或者国际组织与备案保健食品相关的技术法规或者标准原文;
- 产品在产品生产国(地区)上市的包装、标签说明书实样
- 由境外注册人常驻中国代表机构办理备案事务的,应当提交《外国企业常驻中国代表机构登记证》扫描件;境外备案人委托境内的代理机构办理备案事项的,应当提交经过公证的委托书原件以及受委托的代理机构营业执照扫描件
- 注册材料应使用中文,外文材料附后。外文证明性文件、外文标签说明书等中文译本应当由中国境内公证机构进行公证,与原文内容一致。
- 境外机构出具的证明文件、委托书(协议)等应为原件,应使用产品生产国(地区)的官方文字,备案人盖章或法人代表(或其授权人)签字,需经所在国(地区)的公证机构公证和中国驻所在国使领馆确认。
- 注册备案委托境内的代理机构办理备案事项的,委托书应载明备案被委托单位名称、产品名称、委托事项及委托书出具日期。
- 产品功效成分或标志性成分;
- 卫生学;
- 稳定性试验;
- 产品技术要求全项目检验;
- 其他若有必要的试验;
- 自检报告;
- 功效成分或标志性成分检验方法的方法学验证;
- 毒理学试验;
- 人体试食试验。
| 主要步骤 |
预估时间 |
| 可行性分析 |
7个工作日 |
| 样品准备 |
视具体情况而定 |
| 试验检测 |
8-16个月 |
| 卷宗编写与提交 |
2-3个月 |
| 受理机构受理 |
5个工作日 |
| 移交保健食品审评中心 |
3个工作日 |
| 技术审评 |
60个工作日 |
| 现场核查和复核检验 |
进口产品视具体情况而定 |
| 补正资料 |
3个月内 |
| 报送审评结论至国家食药总局 |
5个工作日 |
| 作出审批决定,并发出证书 |
33个工作日 |
| 合计 |
2-3年 |

