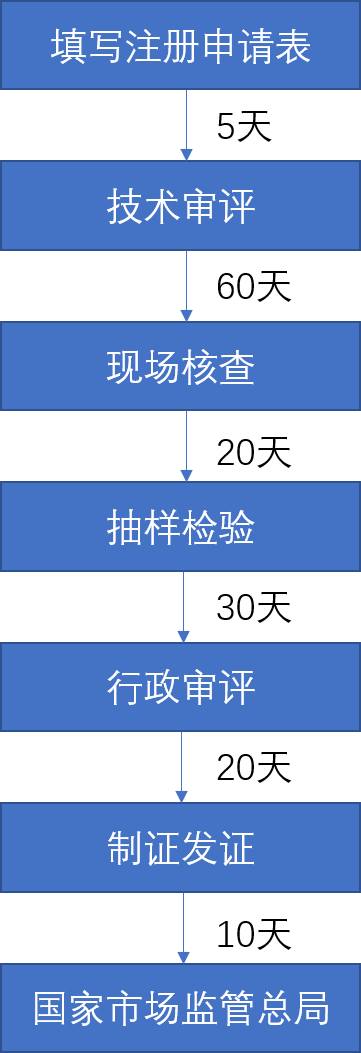
输华流程
一、配方注册
《中华人民共和国食品安全法》第八十条:特殊医学用途配方食品应当经国务院食品药品监督管理部门注册。
- 申请人应当是生产企业,包括拟向我国境内生产并销售特殊医学用途配方食品的生产企业和拟向我国境内出口特殊医学用途配方食品的境外生产企业。
- 申请人应当具备相应的研发能力,设立特殊医学用途配方食品研发机构并配备专职的产品研发人员,研发机构中应当有食品相关专业高级职称以上或者相当专业能力的人员。
- 申请人应当具备相应的生产能力,配备食品安全管理人员和食品专业技术人员,执行特殊医学用途配方食品良好生产规范和食品安全管理体系。
- 申请人应当具备按照特殊医学用途配方食品国家标准规定的全部项目逐批检验的能力。
- 国家市场监督管理总局负责婴幼儿配方乳粉产品配方注册管理工作。
- 总局食品审评机构(总局保健食品审评中心)负责注册申请的受理和审评工作。
- 总局审核查验机构(总局食品药品审核查验中心)负责注册的现场核查工作。
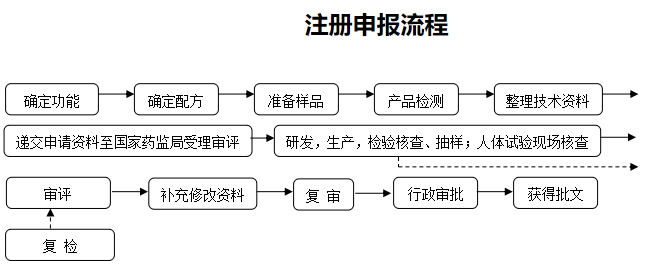
- 特殊医学用途配方食品注册申请书
- 产品研发报告和产品配方设计及其依据
- 生产工艺材料
- 产品标准要求
- 产品标签、说明书样稿
- 试验样品检验报告
- 研发、生产和检验能力证明材料
- 其他表明产品安全性、营养充足性以及特殊医学用途临床效果的材料
- 申请特定全营养配方食品注册,还应当提交临床试验报告
- 与注册申请相关的证明性文件
- 特殊医学用途配方食品延续注册申请书
- 产品注册证书及其附件复印件
- 申请人主体登记证明文件复印件
- 特殊医学用途配方食品质量安全管理情况
- 特殊医学用途配方食品质量管理体系自查报告
- 特殊医学用途配方食品跟踪评价情况
- 产品注册证书及其附件载明事项等内容与上次注册内容相比有改变的,应当注明具体改变内容,并提供相关材料
- 产品注册申请时承诺继续完成的完整的长期稳定性试验研究材料
- 特殊医学用途配方食品变更注册申请书
- 产品注册证书及其附件复印件
- 申请人主体登记证明文件复印件
- 产品已经生产销售的证明材料或产品未经生产销售的情况说明
- 变更事项的具体名称、理由及依据
对于第6,7,8点,进口产品还需提供以下资料:
a)产品生产国(地区)政府主管部门或者法律服务机构出具的境外申请人为境外生产企业的资质证明文件复印件及其中文译本
b)产品生产国(地区)政府主管部门或者法律服务机构出具的允许产品上市销售的证明复印件文件及其中文译本、产品未上市销售的,可不提供
c)该产品生产企业符合相应生产质量管理规范和(或)相应质量管理体系的证明材料
d)由境外申请人常驻中国代表机构办理注册事务的,应当提交《外国企业常驻中国代表机构登记证》复印件。
e)境外申请人委托境内代理机构办理注册事项的,应当提交经过公证的授权委托书原件及其中文译本,以及受委托的代理机构营业执照复印件
二、进口食品收货人备案
- 《进出口食品安全管理办法》(海关总署令第243号)第十九条:海关对进口食品的进口商实施备案管理。
- 《进出口食品检验检疫监督管理办法》(原国家质检总局令第144号)
- 关于发布《进口食品进出口商备案管理规定》及《食品进口记录和销售记录管理规定》的公告(原国家质检总局公告2012年第55号)
- 《质检总局关于启用进口食品进出口商备案系统升级的公告》(原国家质检总局公告2015年第98号)
- 提供的材料真实、齐全、有效;
- 企业法人营业执照经营范围应包含食品或化妆品(货物)的生产、经销和代理等内容,并通过市场监管部门最近一次年度审验
- 外商投资企业应在最近一次联合年检合格;
- 在市场监管部门登记所在地有固定办公场所;
- 建立并有效实施进口食品质量安全管理制度;
- 积极配合海关执行公务,不逃避责任;
- 诚信经营,无违法、违规行为。
工商注册登记地海关
- 进口食品收货人备案申请表;
- 与食品安全相关的组织机构设置、部门职能和岗位职责;
- 拟经营的食品种类、存放地点;
- 2年内曾从事食品、化妆品进口、加工和销售的,应当提供相关说明(品种、数量);
- 登录“进口食品境内进口商备案管理系统”(该系统已与“互联网+海关”一体化平台集成),录入并提交有关信息。
- 将以上所需资料准备齐全后,到当地海关办公区递交资料。企业对所提交资料的完整性、有效性、准确性负责,保证在发生紧急情况时可以通过备案信息与相关人员取得联系。

